医疗人工智能:如何抓住四大机遇,应对四大挑战
来源 : 科技锋网
发布日期 : 2021-07-07
点击量 : 41
人工智能(AI)正越来越多地应用于制药和医疗器械行业,它有望提高产品开发的效率,为延长患者生命提供创新的解决方案。然而,这一新兴领域将对现有监管系统提出挑战。因此,利益相关者必须通过合作,确保监管体系的顺利发展,以适应人工智能带来的变化。
本文主要内容包括:
四大机遇:AI有望改善医疗产品的研发和生命周期管理
1.使用AI工具评估临床试验的纳入/排除标准;
2.在II期临床试验中使用人工智能识别临床活动;
3.从非结构化文本中提取数据;
4.自动化行政工作。
四大挑战:人工智能深入临床面临着监管挑战
1.如何验证不断“学习”的AI软件;
2.如何评估从新的基于AI的临床端点发出的安全信号;
3.如何审查使用AI的医疗技术;
4.人工智能系统需要数据——谁拥有患者的数据?
四大机遇:AI有望改善医疗产品的研发和生命周期管理
机遇1:使用AI工具评估临床试验的纳入/排除标准
在临床试验中,人工智能可用于评估与影像学或组织病理学相关的纳入和排除标准。因为第一批使用人工智能技术的诊断工具已经进入市场,所以这种应用是意料之中的。有了这些工具,对已有纳入/排除标准的评估过程将会变得更快,同时成本也会随着标准化程度的提高而降低。
对于低收入到中等收入国家来说,AI工具特别重要。当需要通过血液或组织等生物样本诊断疾病时,这些国家通常缺乏本国专家来评估生物样本。AI工具可以有效简化这一过程,帮助研究人员在当地进行样本评估,而不需要复杂且耗时的跨国运输。
机遇2:在II期临床试验中使用人工智能识别临床活动
利用人工智能评估新药的临床疗效可以降低成本、加快临床研发、尽早为患者带来新疗法,比如在II期试验中评估CT扫描或MRI扫描的成像端点。基于人工智能的算法可以优化成像结果的读取和评估,减少阅读器之间和内部的可变性,从而提高测量的灵敏度和特异性。如果这一工作不再需要放射科医生,那么可以有效地加快测量过程并降低成本。
另一个应用是开发新的临床试验终点,因为人工智能算法可以帮助减少试验患者数量。例如,帕金森病患者可以在手腕上佩戴加速度计,就像健身追踪器一样。该加速度计将提供患者运动障碍及其随时间变化的连续数据,然后人工智能算法对这些数据进行评估,以区分患者是处于ON状态还是OFF状态,从而记录药物是否能起到改善病情的作用。与患者日记或帕金森病综合评分量表(UPDRS)相比,这种评估方法可以极大降低可变性,因为UPDRS量表无法测量ON和OFF状态的确切时间。如果确认了临床终点,降低的变异性可能有助于招募更少的II期患者,以确定一种新药的治疗效果。
图1是关于帕金森病的一项临床研究,该研究与样本量以及是否持续监测有关。根据目前的UPDRS-III量表,在12个月的时间内,与患者日记等标准护理相比,超过300名患者(每只手臂150名患者)需要检测到疾病进展的放缓幅度大于40%。通过使用加速度计进行持续监测,大约有80名患者(每只手臂40名患者)达到预期结果的80%。
这使得之前假设的端点可变性,与UPRS-III相比,需要除以4。这种方差的降低是很有可能的,因为UPDRS-III量表与极端的变异性有关,在一年的时间内只能评估几次,例如四到六次,因为它需要患者去医院接受检测,并在没有服用左旋多巴(L-dopa)的情况下进行评估。通过连续而不是交错的评估,从而提高运动活动的个别轨迹。而减少样本量会使研究成本更低,执行速度更快。
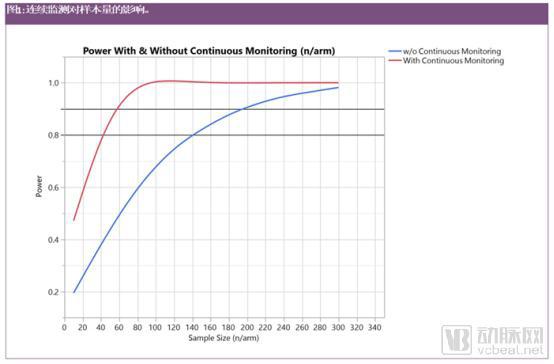
研究人员预计这种技术进步将对II期临床试验产生最大影响,因为III期临床试验需要足够多的患者来准确评估新产品的安全性,并在更大的样本容量中验证II期临床试验结果。此外,在任何新的临床终点可以作为常规的替代终点证明临床效益之前,都需要经过大量的验证过程。=
机遇3:从非结构化文本中提取数据
我们可以从卫生局、医疗保健公司和互联网的非结构化文本中获得有价值的信息。其中包括关于智能监管等相对复杂的信息,但也有简单的数据,一旦这些数据被提取并转移到数据库中,研究人员就可以很容易地对其进行评估。
使用自然语言处理(NLP)进行文本挖掘的新工具为从文档中提取信息和数据以及随后自动上载到数据库中进行分析提供了新的可能性。现在已经有了基于人工智能的工具,可以从非结构化文本(如产品特性摘要)中提取数据来识别药品(IDMP)(如物质名称或强度)(见图2)。
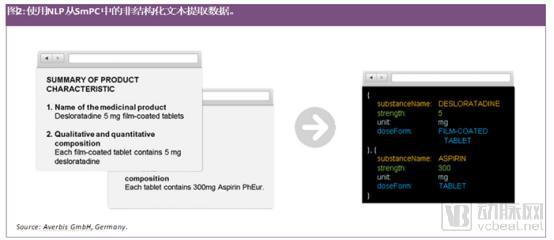
文本挖掘工具让卫生当局以及制药公司能够更好地制作化学成分生产和控制(CMC)的文档和指南。这些工具帮助卫生局通过不同应用程序和营销授权来评估文档。比如在生产过程中发现产品有相同的化学杂质或者寻找一种用于制造新生物实体的特定原材料。这将帮助卫生局的审查人员改进其决策的制定,与此同时,帮助制药公司从卫生当局的规定中自动提取信息并将其导入智能监管系统。而这两项任务,都需要能够理解CMC文档的NLP软件。该软件需要访问大量数据,才能快速、高效、高质量地实现预期结果,给卫生当局以及行业利益相关者带来最大的利益。
机遇4:自动化行政工作
卫生当局和医务工作者管理着大量的行政工作,而机器人流程自动化(RPA)和机器学习(ML)可以帮助他们减轻工作负担。例如,一项对监管优化组织(ROG)的审查显示,在欧盟,约有400名全职员工受雇于有关当局及行业,负责管理IA型变异。在人工智能联盟会议上,参会人员就AI/RPA如何帮助自动化处理IA型变异进行了讨论,前提是有关企业可以在没有授权批准的情况下实施,但需要在特定时间告知卫生当局这一情况。
人工智能在这方面的一个应用是从扫描文件(如登记证或贸易登记册副本)中智能提取信息,并使用“SPOR”标准将这些信息转移到数据库中,包括实体、产品、组织和参考数据(详见图3)。这种技术已经用于发票的自动处理,其中发票上的数据可以被提取到ERP系统中。
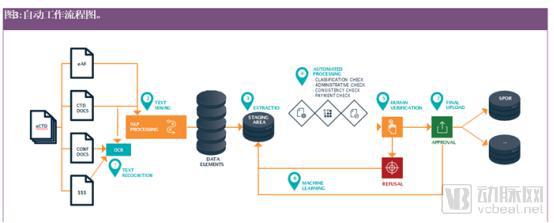
注:光学字符识别(OCR)将文本和图形从(扫描)图像转换为机器可读数据/文本
1.CTD文档应该是可搜索的PDF格式,但是确认文档或付款证明需要OCR;
2.文本挖掘通过使用NLP将非结构化信息从文本转换为结构化信息/数据,例如,MAH或制造商的地址、产品、物质名称、剂型和给药途径等信息;
3.提取已经确定的结构化信息(“片段”)并转移到暂存区域,该区域在处理过程中有结构化信息;
4.作为自动化处理的一部分,进行各种一致性检查;
5.系统显示工作流程和一致性检查的结果,人类处理器,人类可以纠正潜在的错误并最终批准数据集;
6.系统通过学习人类处理的修正,来逐渐改进其性能;
7.使用确定的标准(如SPOR),将识别出的结构化信息传输到相关的数据库中。
四大挑战:人工智能深入临床面临着监管挑战
挑战1:如何验证不断“学习”的AI软件
人工智能系统在不断地学习,因此它们在未来的医疗保健中有着巨大的应用潜力。然而,这也产生了一个很重要的问题,即当基于人工智能的软件在使用过程中持续学习时,应该如何以及何时对其进行验证。其中一种方法是以交错的方式验证它,以便在一定数量的学习周期之后能够重新验证它。而另一个问题在于验证方法是否会产生风险,因为研究人员假设完全自主学习解决问题的系统风险更高,因此需要比使用ML技术进行优化的工具更严格的验证。此外,还需要对“人工评分者”和最终结果进行验证。因此,在任何情况下,都需要进行讨论,以确定最合适的方法来验证基于AI的软件。
挑战2:如何评估从新的基于AI的临床端点发出的安全信号
正如前面强调的,基于AI的技术帮助开发用于识别临床疗效的新端点。然而,这些数据可能包括必须进行彻底评估的安全信息。在前面使用腕式加速度计对患者进行持续监测的例子中,数据可以识别患者是否跌倒或是否处于活动状态。因此,在实施这种新方法时,必须适当考虑如何从这些数据中获取和评估安全信号。
挑战3:如何审查使用AI的医疗技术
越来越复杂的医疗设备/软件,包括那些采用人工智能技术的设备/软件,正给监管部门带来越来越大的审查挑战。例如,最近第一个人工智能软件获得批准,该软件可以在不需要专家的情况下识别疾病。此外,利用深度学习技术训练神经网络,可以从皮肤镜图像中诊断出黑色素瘤。这些产品在美国由FDA审查和批准,而在欧盟,医疗器械认证体系已经比较完善。因此,欧盟成员国确定了60个第三方指定机构,来决定医疗设备/软件是否符合指令93/42/EEC。对于这么多组织来说,达到并保持必要的知识深度,以规范日益复杂的技术产品是很困难的,尤其是因为他们不仅需要了解技术而且还需要了解设备应用的疾病。人工智能联盟会议质疑向欧盟卫生当局分配的医疗设备/软件审查,并认为这是一种集中的方式,以确保适当的专业知识可用于评估。
挑战4:人工智能系统需要数据——谁拥有患者的数据?
人工智能系统需要数据来进行“学习”,在许多医疗应用中,所需数据来自患者。使用这些数据开发的工具可能会为未来的患者护理提供便利,但也可能只是作为商用。在这种情况下,问题的关键在于谁拥有数据以及随后开发的工具。这个问题的答案并不简单,患者群体、法律专家、医疗服务提供者、行业和医院等利益相关方需要密切合作,按照项目范围和规定要求,根据具体情况逐一做出决定。为了促进使用患者数据开发基于人工智能的创新工具,必须建立并实施具有一致标准的国际框架体系。因此,关于这个主题的讨论是很有必要的,并且应该考虑数据匿名化等问题。
结论
本文基于今年在瑞士巴塞尔举行的人工智能联盟会议,该会议讨论了卫生当局和有关行业应该如何促进人工智能的使用,以加速临床开发和提高监管过程的效率。参与讨论的监管人士一致认为,人工智能为未来改善医疗提供了无数机会,其潜力在于:
1.改善临床开发期间收集到的数据的可靠性;
2.减少产品从研发到上市的时间和成本;
3.降低卫生部门和相关行业从业人员的工作负担;
4.开发更多创新的医疗产品。
人工智能技术在医疗领域的应用,既是机遇也是挑战,无论是监管层还是产业界,各国都还没有充分准备好以迎接这一新鲜事物,在探索中前行。